Melkmeisje
Well-known member
Ivermectin Promotes Peripheral Nerve Regeneration during Wound Healing - PMC
Peripheral nerves have the capacity to regenerate due to the presence of neuroprotective glia of the peripheral nervous system, Schwann cells. Upon peripheral nerve injury, Schwann cells create a permissive microenvironment for neuronal regrowth by ...
het onderzoek wat hier boven genoemd is, vertaald:
Perifere zenuwen zijn in staat te regenereren door de aanwezigheid van neuroprotectieve glia van het perifere zenuwstelsel, Schwann cellen. Bij perifere zenuwbeschadiging creëren Schwann cellen een permissieve micro-omgeving voor neuronale hergroei door cytotoxisch glutamaat op te nemen en neurotrofe signaalmoleculen uit te scheiden. Verminderd herstel van de perifere zenuwen wordt vaak veroorzaakt door een defecte Schwann cel respons na verwonding, en er is een kritieke nood aan de ontwikkeling van nieuwe strategieën om zenuwregeneratie te verbeteren, vooral in organismen met een beperkt regeneratief potentieel, zoals de mens. Eén benadering is het onderzoeken van mechanismen in lagere organismen, waarin zenuwherstel veel efficiënter verloopt. Een recente studie toonde aan dat het antiparasitaire geneesmiddel ivermectine hyperinnervatie veroorzaakt van primordiaal oogweefsel in Xenopus laevis kikkervisjes. Onze studie had tot doel de rol van ivermectine in het herstel van zenuwen bij zoogdieren te onderzoeken. We voerden in vitro testen uit met menselijke geïnduceerde neurale stamcellen (hiNSCs) in co-cultuur met menselijke huidfibroblasten (hDFs) en ontdekten dat met ivermectine behandelde hDFs de proliferatie en migratie van hiNSCs bevorderen. We hebben ook de effecten van ivermectine op hDF's gekarakteriseerd en ontdekten dat ivermectine ervoor zorgt dat hDF's extracellulair glutamaat opnemen, gliale cel-afgeleide neurotrofe factor afscheiden, een langgerekte bipolaire morfologie ontwikkelen en gliale fibrillaire zure proteïne tot expressie brengen. Tenslotte, in een overeenkomstig in vivo model, vonden we dat gelokaliseerde ivermectine behandeling in een dermale wond de upregulatie van zowel gliale als neuronale markers induceerde na genezing. Samenvattend tonen we aan dat ivermectine de regeneratie van perifere zenuwen bevordert door fibroblasten aan te zetten tot een glia-achtig fenotype.
1. Inleiding
In tegenstelling tot het centrale zenuwstelsel, heeft het perifere zenuwstelsel (PNS) een aanzienlijke capaciteit tot herstel na verwonding. Hoewel het herstel van perifere zenuwen relatief efficiënt is, zijn er gevallen waarin dit proces belemmerd of zelfs verhinderd wordt. Ongeveer 20 miljoen Amerikanen lopen schade op aan de perifere zenuwen als gevolg van medische aandoeningen en/of trauma.1 Neuropathie bijvoorbeeld, een aandoening die optreedt bij beschadiging of verstoring van de perifere zenuwen, veroorzaakt vaak pijn en/of verlies van gevoel en beweging, en kan het gevolg zijn van diabetes, bepaalde auto-immuunziekten, infectie met het humane immunodeficiëntievirus en behandeling met chemotherapie. Bovendien leidt 3-10% van alle traumatische letsels tot acute perifere zenuwbeschadiging waarvoor chirurgisch ingrijpen nodig is.2 Minder dan de helft van de patiënten met traumatisch letsel die chirurgisch zenuwherstel ondergaan, krijgen een goede tot uitstekende motorische functie en gevoel terug. Dit type van onherstelbare perifere zenuwbeschadiging kan een negatieve invloed hebben op de levenskwaliteit van de patiënt en kan leiden tot ernstige en blijvende sensorische en motorische functiestoornissen die kunnen resulteren in volledige verlamming of de ontwikkeling van chronische neuropathische pijn.3 Axonaal verlies en defecte axonale hergroei zijn verantwoordelijk voor deze kritieke tekortkomingen in het herstel van de perifere zenuwen, terwijl gesuggereerd wordt dat de micro-omgeving rond axonen een essentiële rol speelt in dit proces.
Het aangeboren vermogen tot herstel van de perifere zenuwen kan tenminste gedeeltelijk worden toegeschreven aan de zeer regeneratieve gliacellen van het PNS, de Schwann cellen. Verschillende dierstudies hebben aangetoond dat slechte axonregeneratie na perifere zenuwbeschadiging tenminste gedeeltelijk te wijten is aan een defecte Schwann cel respons.4 Schwann cellen myeliniseren perifere zenuwen en spelen een essentiële rol in axon geleiding en regeneratie. Bij perifere zenuwbeschadiging, degenereren distale axonen, terwijl residente Schwann cellen dedifferentiëren, proliferatief worden, en helpen om een permissieve micro-omgeving te creëren voor daaropvolgende neuronale hergroei.5 Schwann cellen zijn bijvoorbeeld betrokken bij de opname van cytotoxisch glutamaat bij neuronale beschadiging.6 Bovendien scheiden Schwann cellen ook extracellulaire signaalmoleculen af om zenuwregeneratie te bevorderen. Eén van de extrinsieke factoren die door Schwann cellen geüpreguleerd worden in reactie op perifere zenuwbeschadiging is gliale cel-afgeleide neurotrofe factor (GDNF).7 GDNF blijkt neuronale groei en overleving te bevorderen en wordt algemeen gebruikt in de ontwikkeling van verschillende therapeutische strategieën voor experimenteel zenuwherstel, zoals diabetische neuropathie8 en nervus ischiadicus transectie.9 Gedifferentieerde Schwann cellen vertonen een langgerekte, bipolaire morfologie en beginnen bepaalde cytoskeletale proteïnen te upreguleren, waaronder gliaal fibrillair zuur eiwit (GFAP). GFAP verschijnt tijdens de vorming van onrijpe Schwann cellen en wordt gedereguleerd bij myelinisatie.10 Interessant is dat GFAP een prominente rol speelt in de regeneratie van perifere zenuwen, omdat werd aangetoond dat neuronale hergroei na verwonding vertraagd was bij GFAP-nul muizen, wat waarschijnlijk te wijten is aan tekortkomingen in de Schwann celregulatie.11
Er zijn strategieën ontwikkeld om perifere zenuwbeschadigingen te behandelen, maar deze hebben een aantal beperkingen. Voor patiënten die grotere zenuwdefecten en/of traumatische letsels moeten herstellen, is de primaire behandeling een autoloog zenuwtransplantaat, wat meerdere nadelen heeft, zoals beperkte beschikbaarheid van opofferingszenuwweefsel, morbiditeit van de donorplaats en mogelijke neuroma vorming.3 De huidige behandeling voor diabetische neuropathie, die wordt veroorzaakt door distale zenuwdood in de extremiteiten als gevolg van slechte vascularisatie en hoge bloedglucosespiegels, is pijnbestrijding, wat de eigenlijke zenuwschade niet behandelt. Er zijn ook verschillende experimentele modellen die proberen de resultaten van diabetische neuropathie te verbeteren. Bijvoorbeeld, een recente studie maakte gebruik van herpes simplex virus vector-gemedieerde genoverdracht van vasculaire endotheliale groeifactor voor subcutane inoculatie in de huid in een muismodel van diabetische neuropathie.12 Hoewel deze gelokaliseerde behandeling in staat was om de aanwezigheid van zenuwvezels in de huid aanzienlijk te verhogen, is deze methode van viraal geïnduceerde genoverdracht niet geschikt voor bepaalde klinische toepassingen.
Gezien de verschillende tekortkomingen van de huidige behandelingsopties, is er een kritieke behoefte om nieuwe doelwitten te identificeren en nieuwe strategieën te ontwikkelen om het probleem van verminderde zenuwregeneratie te bestrijden. Eén benadering is het onderzoeken van mechanismen in lagere organismen, waar het herstel van perifere zenuwen veel robuuster en efficiënter is. Bepaalde soorten salamanders, zoals de axolotl, kunnen volledige geamputeerde ledematen regenereren, inclusief volledig functionele neurale componenten met tactiele sensatie en beweging.13 Veel studies hebben zich gericht op het begrijpen waarom deze amfibieën zo'n hoge regeneratieve capaciteit behouden tot in de volwassenheid, terwijl veel andere gewervelde soorten dit niet doen. Interessant is dat denervatie van de axolotl ledemaat na amputatie de regeneratie van de ledematen remt, wat suggereert dat een goede innervatie cruciaal is, niet alleen voor het herstel van de zenuwfunctie, maar ook voor het herstel van het weefsel van de ledematen in het algemeen.14
Hoewel dit organisme de aangeboren capaciteit heeft voor volledige regeneratie, zijn vergelijkbare soorten niet zo regeneratief, maar vertonen een veel grotere capaciteit tot herstel dan zoogdiersystemen. De Zuid-Afrikaanse klauwkikker Xenopus laevis bijvoorbeeld kan de staart, het ruggenmerg en de ledematen gedeeltelijk regenereren, maar niet in dezelfde mate als salamanders, omdat zijn regeneratievermogen gestaag afneemt naarmate het dier ouder wordt.15 Inzicht in mechanismen om het regeneratievermogen te verhogen wanneer deze dieren overgaan van regeneratief naar niet-regeneratief, kan nuttig zijn bij het uitwerken van strategieën om het herstelvermogen van zoogdieren te verhogen, vooral gezien de bewezen vermindering van het regeneratievermogen tijdens de veroudering bij de mens.16 Zo toonde een recente studie in een Xenopus gastheermodel aan dat ivermectine de innervatie kan verbeteren van primordiaal oogweefsel dat geënt is op de flanken van kikkervisjes in een vroeg stadium.17 Ivermectine is een gevestigd antiparasitair geneesmiddel dat veel gebruikt wordt in zowel klinische als diergeneeskunde. Bij de mens wordt ivermectine gebruikt bij de behandeling van onchocerciasis, maar het is ook effectief tegen andere wormbesmettingen, zoals strongyloidiasis, en tegen sommige parasitaire huidziekten, waaronder schurft.18 Bij hogere doses blijkt ivermectine te werken als een positieve regulator van een verscheidenheid van ionenkanalen en receptoren, zoals glycine19 en purinerge receptoren,20 waarvan er vele ook aanwezig zijn in zoogdiercellen. Het lokaal stimuleren van deze ionenkanalen op de plaats van de zenuwbeschadiging heeft de potentie om zenuwgroei en herstel te initiëren. Wij veronderstelden dat deze nieuw ontdekte methode om de innervatie te verhogen bij kikkers in een niet-regeneratief stadium ook nuttig kan zijn voor het induceren van innervatie bij organismen met een beperkt regeneratief potentieel, zoals mensen.
Het doel van dit werk was om de effecten van ivermectine op het herstel van de perifere zenuwen bij zoogdieren te onderzoeken. Daartoe ontwikkelden we eerst een reeks in vitro testen met behulp van menselijke geïnduceerde neurale stamcellen (hiNSCs).21 Met behulp van een driedimensionale (3D) bilaag collageen gel co-cultuur systeem met menselijke dermale fibroblasten (hDFs) en hiNSCs als een eenvoudige in vitro tool voor het begrijpen van de complexe interacties tussen deze twee verschillende celtypes, vonden we dat voorbehandeling van hDFs met ivermectine de proliferatie van aangrenzende hiNSCs aanzienlijk deed toenemen. Evenzo vonden we in migratieproeven met voorgedifferentieerde hiNSCs dat met ivermectine behandelde hDFs een significante toename in neuronale migratie veroorzaakten. We hebben ook de effecten van ivermectine op hDF's in vitro verder gekarakteriseerd, en ontdekten dat ivermectine ervoor zorgde dat hDF's extracellulair glutamaat opnamen, GDNF afscheidden, een langgerekte bipolaire morfologie ontwikkelden, en GFAP tot expressie brachten, wat suggereert dat ivermectine ervoor zorgt dat hDF's een glia-achtig fenotype aannemen. Tenslotte vertaalden we onze in vitro bevindingen naar een relevant in vivo model en ontdekten dat gelokaliseerde ivermectine behandeling in een dermale wond de upregulatie van zowel gliale als neuronale markers induceerde bij genezing. Al met al onthullen onze gegevens een nieuwe rol voor ivermectine in het bevorderen van perifere zenuwregeneratie tijdens wondgenezing bij zoogdieren.
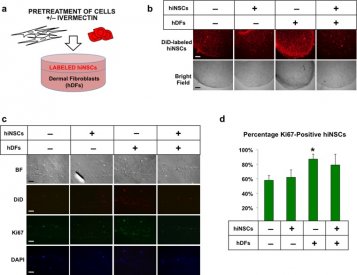
Vergelijkbaar met bevindingen uit eerdere Xenopus experimenten die niet-cell-autonome effecten op neurale groei aangegeven,17 zagen we toegenomen neurale groei alleen in die constructen, waarin hDF's werden voorbehandeld met ivermectine (FiguurFigure11B). Na cryosectioning deze bilaag gels, vonden we dat hiNSCs in deze constructen aanzienlijk hogere niveaus van proliferatie marker Ki67
(FiguurFigure11C,D) uitgedrukt, wat suggereert dat ivermectine behandelde hDFs geïnduceerde proliferatie in aangrenzende hiNSCs in 3D-bilaag co-culturen.
2.2. Ivermectine-behandelde fibroblasten induceren migratie van gedifferentieerde neuronen
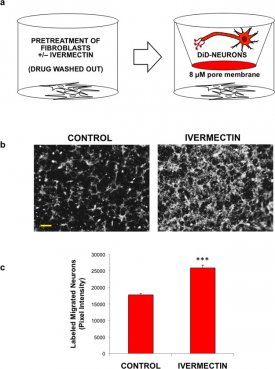
Na vastgesteld dat ivermectine-behandelde hDFs proliferatie van neurale stamcellen geïnduceerd, we ook gericht op hun potentiële effecten op neuronale migratie te bestuderen. Om dit te testen, hebben we gezaaid hDF's in de onderste transwell van celkweekplaten, behandeld met DMSO of 1 uM ivermectine, vervolgens herhaaldelijk gewassen om residueel geneesmiddel (FiguurFigure22A) te verwijderen. In de top van de transwell op de gecoate 8 porie umembraan, we gezaaid DiD gelabelde menselijke neuronen om het effect van proliferatie in de test te minimaliseren. We gebruikten hiNSCs die waren gepredifferentieerd voor 1 week die niet langer proliferatieve en uitgedrukt hoge niveaus van pan-neuronale merker β III tubuline (Tuj1) (figuur S2A). Deze transwell systemen werden gekweekt in een laag serum media 's nachts (om verder te minimaliseren potentiële celproliferatie), en het relatieve aantal cellen migreren naar de bodem van transwells werd gekwantificeerd (FiguurFigure22B,C). Interessant is dat ivermectine behandelde hDFs toonde een significante toename van neuronale migratie ten opzichte van de controle behandelde cellen.
Figuur 2
Behandeling van dermale fibroblasten met ivermectine induceert migratie van gedifferentieerde neuronen. (a) Schematische weergave van de experimentele opzet. Menselijke huidfibroblasten werden gezaaid op de bodem van celkweekplaten, vervolgens behandeld met of zonder ivermectine, en herhaaldelijk gewassen om het geneesmiddel te verwijderen. Gedifferentieerde DiD gelabelde neuronen werden uitgezaaid op gecoate transwells (8 uM poriegrootte), die werden geplaatst in de putjes met fibroblasten. Cellen werden gekweekt in een laag serum media (om potentiële celproliferatie te minimaliseren) 's nachts, en het relatieve aantal cellen migreren naar de bodem van de transwells werd gekwantificeerd. (b) Beelden van fluorescent gelabelde neuronen die gemigreerd naar de bodem van transwells na co-cultuur met dermale fibroblasten voorbehandeld met of zonder ivermectine, schaal bar: 200 pM. (c) Kwantificering van gemigreerde cellen. *P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001; zoals bepaald door twee-tailed t-test. Foutbalkjes tonen gemiddelde ± SD.
Samenvattend tonen we aan dat ivermectine behandeling van stromale hDFs, maar niet hiNSCs, had een diepgaand effect op neurale groei. Belangrijk is, omdat het geneesmiddel werd uitgewassen uitgebreid voorafgaand aan de oprichting van beide co-cultuur modellen, dit suggereert dat de verwante effecten waren het resultaat van de eerste voorbehandeling van afzonderlijke celtypes en niet het effect van het geneesmiddel zelf op de gehele co-cultuur constructies.
2.3. Behandeling met Ivermectine zorgt ervoor dat huidfibroblasten functionele kenmerken van gliale cellen overnemen
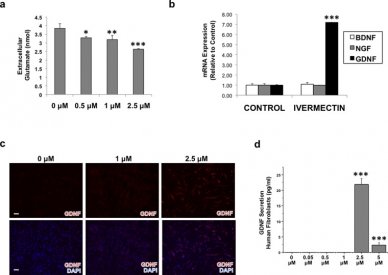
We hebben eerst verondersteld dat ivermectine-behandelde fibroblasten potentieel cytotoxisch glutamaat verwijderen uit de extracellulaire micro-omgeving. Om dit te testen, hebben we hDFs behandeld met verschillende concentraties van ivermectine 's nachts, dan getest de celkweek media om extracellulaire glutamaat concentratie te bepalen. Het werd eerder aangetoond dat fibroblast celkweek media bevat een grote hoeveelheid glutamaat als gevolg van de toevoeging van l-glutamine, een precursor van glutamaat, aan vele soorten media formuleringen.22 Interessant is dat we vonden dat behandeling van hDFs met ivermectine resulteerde in een significante dosis-afhankelijke daling van de extracellulaire glutamaatconcentratie (FiguurFigure33A), wat suggereert dat ivermectine-behandelde fibroblasten zou ook in staat zijn om extracellulaire glutamaat vrijgegeven door neuronen op letsel op te nemen.
Figuur 3
Behandeling met ivermectine veroorzaakt dermale fibroblasten tot extracellulaire glutamaat op te nemen en gliale cellijn-afgeleide neurotrofe groeifactor (GDNF) tot expressie te brengen. (a) Huidfibroblasten werden 's nachts behandeld met verschillende concentraties ivermectine, en de celcultuurmedia werden getest om de extracellulaire glutamaatconcentratie te bepalen. (b) Huidfibroblasten werden behandeld met of zonder 1 uM ivermectine gedurende 4 dagen, vervolgens onderworpen aan kwantitatieve real-time polymerase kettingreactie (qRT-PCR) analyse voor verschillende neurotrofe groeifactoren. (c) Immunostaining resultaten van de huid fibroblasten behandeld met ivermectine tonen een toename van GDNF expressie met toenemende ivermectine concentratie, schaal bar: 100 μM. (d) Enzyme-linked immunosorbent assay (ELISA) van celcultuurmedia geoogst van huidfibroblasten behandeld met ivermectine gedurende 4 dagen toont aan dat GDNF wordt gesecreteerd uit ivermectine-behandelde fibroblasten. *P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001; zoals bepaald door one-way ANOVA met post-hoc Tukey test. Foutbalkjes tonen gemiddelde ± SD.
We veronderstelden dat ivermectine behandeling van hDFs een soort paracrien effect had op naburige hiNSCs. Als zodanig hebben we ook tot doel om te bepalen of ivermectine veroorzaakt fibroblasten om eventuele neurotrofische factoren uit te drukken. We behandelden hDFs met voertuig of 1 uM ivermectine gedurende 4 dagen, en onderwierpen ze vervolgens aan qRT-PCR analyse om de expressie van verschillende groeifactoren te bepalen. We vonden dat hoewel er geen significant effect van ivermectine op brain-derived neurotrophic factor of zenuwgroeifactor na 4 dagen, ivermectine behandelde hDFs dramatisch verhoogde expressie van gliale cellijn-afgeleide neurotrofe factor (GDNF) (FiguurFigure33B), een factor aangetoond dat sterk worden uitgedrukt door astrocyten23 en Schwann cellen.7 Om te bevestigen of GDNF werd ook geüpreguleerd op eiwitniveau, we behandeld hDFs met toenemende hoeveelheden ivermectine en immunokleuring tegen GDNF, en vond dat blootstelling aan ≥1 uM ivermectine GDNF expressie (FiguurFigure33C) verhoogd. Na vaststelling dat GDNF werd verhoogd op zowel het mRNA en eiwit niveau, hebben we ook tot doel om te begrijpen of GDNF werd ook uitgescheiden. hDF's werden behandeld met toenemende concentraties van ivermectine gedurende 4 dagen, en hDF geconditioneerde media werd geoogst, gefilterd, en onderworpen aan GDNF ELISA. Interessant is dat we vonden dat bij concentraties ≥ 2,5 uM, ivermectine veroorzaakt hDFs aanzienlijke niveaus van GDNF eiwit uit te scheiden in de media (FiguurFigure33D). Ivermectine concentraties ≥5 pM bleek cytotoxisch in vitro (Figuur S3).
Om verdere opheldering van de rol van ivermectine-geïnduceerde GDNF expressie in hDFs op gecultiveerde hiNSCs, voerden we neuron migratie experimenten (zoals in FiguurFigure22) in aanwezigheid van een antilichaam dat functioneel blokkeert GDNF, en vond dat dit antilichaam was in staat om de effecten van ivermectine behandelde hDFs op hiNSC migratie (figuur S4) te verminderen.
2.4. Ivermectine-behandelde fibroblasten demonstreren Glia-achtige morfologie en upreguleren GFAP
Na vastgesteld dat ivermectine hDFs bepaalde kenmerken van gliale cellen, met inbegrip van glutamaat opname en afgifte van GDNF veroorzaakt, hebben we ook tot doel om te begrijpen of ivermectine behandelde hDFs ook meer fenotypisch vergelijkbaar met glia worden. Net als bij eerdere experimenten werden hDF's behandeld met toenemende concentraties ivermectine gedurende maximaal 8 dagen, en vervolgens onderworpen aan qRT-PCR en immunokleuring. We onderwierpen de monsters ook aan GeneQuery Human Schwann Cell Biology qPCR Array Kit en ontdekten dat met ivermectine behandelde hDFs meerdere genen tot expressie brengen die betrokken zijn bij verschillende aspecten van Schwann celbiologie, waaronder differentiatie en onderhoud, perifere zenuwregeneratie, en extracellulaire matrixsynthese, met inbegrip van (maar niet beperkt tot) SRY-box 10 (Sox10), S100 calcium bindend eiwit B (S100B), myeline basiseiwit, groei geassocieerd eiwit 43 (GAP43), en neurale cel adhesie molecule 1 (NCAM1) (figuur S5).
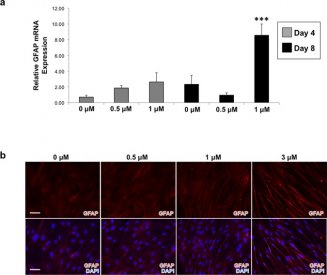
Bovendien qRT-PCR analyse bleek dat hDFs behandeld met 1 uM ivermectine significant hogere niveaus van gliale fibrillaire zure proteïne (GFAP) uitgedrukt op zowel D4 en D8 (FiguurFigure44A). Ook hebben we aangetoond dat toenemende concentraties van ivermectine resulteerde in hogere eiwitexpressie van GFAP, evenals morfologische veranderingen die doen denken aan een Schwann cel-achtig fenotype, steeds zeer dun en langgerekt ten opzichte van controle fibroblasten (FiguurFigure44B). Ten slotte herhaalden we verschillende experimenten met verschillende formuleringen van ivermectine om te bevestigen dat de waargenomen effecten het gevolg waren van het geneesmiddel en niet een niet-specifiek artefact van de drugssynthese. We vonden dat voor alle formuleringen van ivermectine getest, GFAP was upgereguleerd en de fenotypische langgerekte morfologie werd ook waargenomen (figuur S6), wat suggereert dat onze bevindingen met betrekking tot de effecten van ivermectine op hDFs waarschijnlijk werden veroorzaakt door de belangrijkste component van het geneesmiddel zelf en niet door mogelijk verontreinigende bijproducten van het productieproces.
Figuur 4
Behandeling van dermale fibroblasten met toenemende concentraties ivermectine resulteert in de upregulatie van GFAP en de ontwikkeling van een langgerekte morfologie die doet denken aan Schwann cellen. (a) Huidfibroblasten werden gedurende 4 en 8 dagen behandeld met verschillende concentraties ivermectine, en vervolgens onderworpen aan qRT-PCR analyse van de GFAP expressie. (b) GFAP immunokleuring toont aan dat dermale fibroblasten behandeld met relatief hogere concentraties van ivermectine gedurende 8 dagen resulteert in een toename van GFAP expressie en een verandering in morfologie, die lijkt op een Schwann cel-achtig fenotype, schaal bar: 100 μM. ***P ≤ 0,001; zoals bepaald door one-way ANOVA met post-hoc Tukey test. Foutbalkjes tonen gemiddelde ± SD.
2.5. Effect van Ivermectine in een in vivo model van wondgenezing
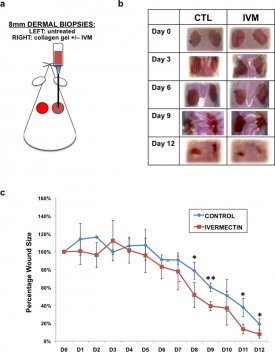
Hoewel onze in vitro resultaten duidelijk aantoonden dat ivermectine een rol speelt in het bevorderen van zenuwregeneratie door de transformatie van huidfibroblasten in een meer gliaal-achtig fenotype, was het belangrijk om te begrijpen of deze effecten ook gezien konden worden in een in vivo model. Na het genereren van overtuigende gegevens, die suggereerden dat met ivermectine behandelde dermale fibroblasten de groei van gecultiveerde neuronen bevorderen, selecteerden we een fysiologisch relevant in vivo systeem dat beide relevante celtypes (dermale fibroblasten en perifere zenuwen) zou omvatten en een vereenvoudigd systeem zou bieden voor gelokaliseerde toediening van ivermectine. Voor dit doel kozen we een huidmodel voor wondgenezing. Twee 8 mm diameter doorsnede biopten werden verwijderd uit de dorsale huid van volwassen mannelijke BALB / c muizen. In de wond aan de rechterkant, 30 pi collageengels met 10 pM ivermectine of DMSO (controle) werden gepipetteerd op de wond en laat stollen (FiguurFigure55A). De linkerzijde wonden bleven onbehandeld en diende als extra controles. Beide wonden werden afgedicht met Tegaderm, en de evolutie van de wond werd gevolgd in de loop van 12 dagen. We stelden vast dat ivermectine gedeeltelijk geholpen wondgenezing zoals bepaald door kwantificering van de wondgrootte in de tijd (FiguurFigure55B). Op dagen 8-9 en 11-12 waren de met ivermectine behandelde wonden aanzienlijk kleiner dan de met DMSO behandelde controles.
Figuur 5
Ivermectine bevordert wondgenezing van dermale biopten in vivo. (a) Schematische weergave van de experimentele opzet. Biopsies (2 × 8 mm2) werden genomen van de dorsale huidlaag van elke muis. In de rechter zijwond, 30 pi collageengels bevattende 10 uM ivermectine of DMSO (controle) werden gepipetteerd op de wond en toegestaan te stollen. De linker zijde wonden bleven onbehandeld, en diende als extra controles. Beide wonden werden afgedicht met Tegaderm, en de evolutie van de wond werd gevolgd gedurende 12 dagen. (b) Beelden van de grove morfologie van de wondgenezing in de tijd. (c) Kwantificering van de wondgrootte na verloop van tijd. *P ≤ 0.05, **P ≤ 0.01; zoals bepaald door t-test met twee staarten. Foutbalkjes tonen gemiddelde ± SD.
2.6. Genezen met Ivermectine behandelde wonden hebben een verhoogde neuronale en gliale marker expressie
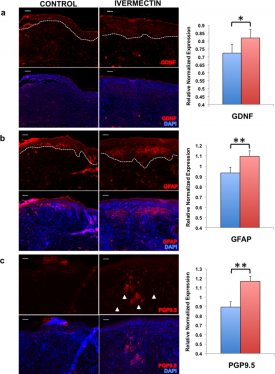
Vervolgens onderzochten we de aanwezigheid van zowel neuronale als gliale markers in het genezen huidweefsel. Dit is vooral belangrijk omdat een verstoorde wondgenezing vaak littekenweefsel veroorzaakt, waarin zenuwen niet goed kunnen regenereren, wat resulteert in verlies van gevoel op de plaats van de wond. Na opoffering op D12, we geëxcideerd en gefixeerd het wondweefsel, onderworpen weefseldelen immunokleuring, en vond significant hogere expressie van afgescheiden factor GDNF (FiguurFigure66A), gliale marker GFAP (FiguurFigure66B), en perifere zenuw marker (PGP9.5) (FiguurFigure66C) in die muizen behandeld met ivermectine-geladen collageen gels in vergelijking met voertuig-controle collageen gels. Deze bevindingen komen overeen met onze in vitro gegevens te suggereren dat ivermectine ook zenuwgroei bevordert door het induceren van de generatie van glia-achtige cellen in een in vivo model van wondgenezing.
Figuur 6
Ivermectine vergemakkelijkt wondgenezing door het induceren van de differentiatie van glia-achtige cellen die zenuwgroei bevorderen. Cryosecties van de wond sites werden immunostained en gekwantificeerd om te testen op de aanwezigheid van (a) gliale afgeleide groeifactor (GDNF), (b) gliale fibrillaire zure proteïne (GFAP), en (c) perifere zenuw marker (PGP9.5), schaal bar: 100 μM. *P ≤ 0.05, **P ≤ 0.01, ***P ≤ 0.001; zoals bepaald door twee-tailed t-test. Foutbalkjes tonen gemiddelde ± SD.
3. Discussie
Hoewel het perifere zenuwstelsel een aangeboren herstelcapaciteit heeft, zijn er verschillende gevallen waarin dit proces verstoord is, vooral bij organismen met een beperkt regeneratief potentieel, zoals de mens. Gezien de beperkingen van de huidige behandelingsmogelijkheden, is er een dringende noodzaak om nieuwe strategieën te ontwikkelen om zenuwregeneratie te bevorderen. Eén benadering is het onderzoeken van mechanismen bij lagere gewervelde dieren, waar het herstel van perifere zenuwen vrij efficiënt verloopt. Onlangs werd aangetoond dat het anthelminicum ivermectine de innervatie verbetert bij kikkers in het regeneratiestadium. Eerdere experimenten uitgevoerd in X. laevis kikkervisjes aangetoond dat een rol voor ivermectine in het bevorderen van verhoogde zenuwgroei van ectopische oogweefsel.17 Fluorescent gelabeld donoroog primordia of ongelabelde gastheer kikkervisjes werden behandeld met of zonder ivermectine voor ectopische enting op het gastheerdier flank. Hyperinnervatie van het geënte oog werd alleen gezien in die dikkopjes, waarbij de donor dikkopje ontvangen ivermectine voorbehandeling (en niet vice versa).17 Deze experimenten bleek dat ivermectine behandeling van niet-neuronale stromale weefsel kan worden benut om de uitbreiding van neuronen van de aangrenzende geënte neuronale weefsel induceren. Hoewel deze resultaten opvallend waren, is het belangrijk om te begrijpen of dit fenomeen specifiek was voor dit amfibie-model of kan worden gerecapituleerd in zoogdiersystemen.
In dit werk hebben we een rol aangetoond voor ivermectine in het bevorderen van de groei van perifere zenuwen bij zoogdieren. We ontdekten dat co-cultuur van hiNSCs met met ivermectine behandelde fibroblasten resulteerde in verhoogde hiNSC proliferatie en migratie. Bovendien ontdekten we dat ivermectine ervoor zorgt dat fibroblasten een gliaal-achtig fenotype aannemen; de opname van extracellulair glutamaat neemt toe, de neurotrofe factor GDNF komt tot expressie, en ze vertonen kenmerken van Schwann cellen, waaronder een langgerekte morfologie en GFAP expressie. Deze getransformeerde gliaal-achtige cellen maken de expansie van neuronen mogelijk, en bieden een ondersteunende omgeving voor zenuwregeneratie. Verder tonen we een fysiologisch relevante in vivo rol aan voor ivermectine in het bevorderen van zenuwregeneratie, gebruikmakend van een murien model van wondgenezing. Belangrijk is dat onze resultaten in overeenstemming zijn met de huidige bevindingen die een cruciale rol impliceren voor perifere glia tijdens weefselregeneratie bij zoogdieren. Recent werd aangetoond dat huidletsel perifere glia activeert in een in vivo model van huidherstel over de volle dikte. Verder werd aangetoond dat depletie van deze geactiveerde glia het wondgenezingsproces functioneel belemmert.24 Op dezelfde manier bevorderde transplantatie van Schwann celprecursors de regeneratie van de digitip via gelokaliseerde secretie van paracriene factoren in een amputatiemodel bij muizen25
Aangezien het door de FDA goedgekeurde Ivermectine momenteel reeds gebruikt wordt voor de behandeling van een verscheidenheid van besmettingen, waaronder schurft, luizen en onchocerciasis,26 zou het gebruik ervan verder aangepast kunnen worden voor klinische toepassingen bij het herstel van perifere zenuwen. Het is bekend dat ivermectine ongewervelde parasieten uitroeit door glutamaat-geactiveerde chloridekanalen die alleen aanwezig zijn in neuronen en spiercellen van deze organismen te binden en te activeren, wat uiteindelijk leidt tot spierverlamming en de dood.26 Bij zoogdieren werd aangenomen dat dit type glutamaat-geactiveerde chloridekanalen alleen tot expressie komt in de hersenen, en daardoor wordt beschermd door de bloed-hersenbarrière: een redenering die ertoe heeft geleid dat het middel veilig werd geacht voor gebruik bij de mens. Bij lage concentraties, vergelijkbaar met die welke in zowel klinische als diergeneesmiddelen worden gebruikt, is er immers in wezen geen waarneembaar effect op dit soort zoogdierhersenspecifieke glutamaat-doorlaatchloridekanalen. Er is echter aangetoond dat ivermectine bij hogere concentraties (d.w.z, micromolair bereik) kan werken als een allosterische modulator van meerdere kanalen, waaronder de menselijke glycinereceptor;19 γ-aminoboterzuur A (GABAA) receptoren van kippen,27 knaagdieren,28 en mensen;29 kip en menselijke α7 nicotinereceptoren;30 evenals menselijke purinerge receptoren P2X420 en P2X7.31 Veel van deze receptoren worden aangetroffen in meerdere celtypen bij zoogdieren en meer specifiek bij mensen, wat suggereert dat de effecten van ivermectine mogelijk wijder verspreid zijn dan aanvankelijk gedacht.
In de micro-omgeving van een genezende wond zijn er meerdere celtypes betrokken bij het genezingsproces, waarvan vele bekend zijn om een aantal relevante ionkanalen tot expressie te brengen. Van menselijke fibroblasten is bijvoorbeeld aangetoond dat ze veel van de bovengenoemde receptoren tot expressie brengen, zoals glycine,32 GABA,33 purinerge,34 en nicotinerge.35 Deze endogene expressie in combinatie met de relatief aspecifieke binding en werking van ivermectine op een verscheidenheid van verschillende ionenkanalen en receptoren maakt het enigszins moeilijk om vast te stellen op welke specifieke receptor of receptoren ivermectine inwerkt in onze in vitro en in vivo systemen. Deze complexiteit van mogelijke interacties van ivermectine met meerdere kanalen en receptoren beperkt het inzicht in het werkingsmechanisme. De bevindingen hier leveren echter overtuigend bewijs voor een bredere invloed van ivermectine, zowel wat betreft de downstream werkzaamheid als de potentiële klinische bruikbaarheid.
Hoewel de effecten van ivermectine op neuronale en gliale groei in vivo zeer opvallend waren, is het belangrijk te erkennen dat het effect van het geneesmiddel op wondsluiting niet zo diepgaand was. Het is algemeen bekend dat wondgenezing bij gezonde muizen bijzonder moeilijk experimenteel te verbeteren is,36 en meer in het bijzonder is van de in deze studie gebruikte BALB/c wildtype muizen bekend dat zij relatief snel genezen.37 Het zal belangrijk zijn om na te gaan of dit geneesmiddel ook een rol kan spelen bij het verbeteren van zenuwregeneratie in andere modellen, waarin de zenuwafwijking dieper is en/of aangetast. Vergelijkbare experimenten zouden bijvoorbeeld herhaald kunnen worden in verschillende in vivo modellen van neuropathie, die vaak geassocieerd wordt met andere co-morbiditeiten, zoals diabetes, auto-immuunziekten en behandeling met chemotherapie.38 Ivermectine zou ook onderzocht kunnen worden op zijn mogelijke toepassing bij het bevorderen van herstel van grotere modellen van zenuwdefecten, zoals nervus ischiadicus resectie of ruggenmergschade. Bovendien, omdat we aantonen dat ivermectine fibroblasten GDNF laat afscheiden, kan deze techniek ook aangepast worden als een methode om endogene gelokaliseerde afgifte van GDNF te induceren als een potentieel analgeticum39 om innervatie te bevorderen in ischemisch weefsel40 of misschien verder aangepast worden om strategieën van GDNF afgifte te ontwikkelen voor de behandeling van de ziekte van Parkinson.41
Ga naar:
4. 4. Materialen en methodes
4.1. Generatie van hiNSCs
hiNSC lijnen werden gegenereerd zoals eerder beschreven.21 In het kort, menselijke neonatale voorhuid fibroblasten (een gift van Dr Jonathan Garlick, Tufts University) werden geïnfecteerd met een lentivirus uitdrukken herprogrammering factoren OCT4, KLF4, SOX2, en cMYC in een polycistronische vector (Addgene # 24603, een gift van Jose Cibelli). Geconcentreerd virus werd gebruikt in combinatie met polybrene (Millipore) in fibroblast media bij een MOI van 1-2. Media werden uiteindelijk veranderd in hiNSC media: knock-out (KO) Dulbecco's gemodificeerd Eagle's medium (DMEM) aangevuld met 20% KO xenovrije SR, 20 ng / ml recombinant bFGF, 1% Glutamax, 1% antibioticum-antimycoticum, en 0,1 mM b-mercaptoethanol, die ook bevatte 1% KO groeifactor cocktail (GFC) (Invitrogen). Cellen werden later getrypsiniseerd en uitgezet op muis embryonale fibroblast (MEF) feeder lagen eerder geïnactiveerd door mitomycine C. hiNSC medium (zonder KO-GFC) werd vervolgens veranderd om de 1-3 dagen. Op dag 30 of later, werden kolonies mechanisch geplukt en doorgegeven aan vers mitotisch geïnactiveerd MEFs. Kolonies werden uitgebreid door enzymatisch passaging met behulp van TrypLE (Invitrogen) op MEF feeders. Elke geplukte kolonie vertegenwoordigde een hiNSC lijn.
4.2. Ivermectine Bereiding
Verschillende formuleringen van ivermectine werden gekocht van verschillende bronnen, waaronder Sigma-Aldrich (Natick, MA), Tocris (Minneapolis, MN) of Cayman Chemical (Ann Arbor, MI). Voor alle bereidingen van het geneesmiddel werd DMSO gebruikt voor reconstitutie vanuit de gelyofiliseerde vorm.
4.3. Drie-dimensionale Collageen Gel hiNSC Co-culturen
Menselijke dermale fibroblasten (hDFs) en hiNSCs werden behandeld met 1 uM ivermectine of 1 uM DMSO (controle) gedurende 6 uur. hiNSCs werden gedissocieerd en gelabeld met lipofiele fluorescerende kleurstof DiD (Invitrogen) volgens protocol van de fabrikant om hun groei te volgen in het collageen gels. Collageen gel mix werd gemaakt met 68% 1,5 × DMEM (Invitrogen), 30% Rat Tail Collageen I (Corning), en 2,5% 0,8 M NaHCO3. De onderste laag van het collageen gel werd gezaaid met 104 hDF / gel in 20 pi gels, gepipetteerd in vier wells platen (Nunc), en gedeeltelijk stollen gedurende 20 min bij 37 ° C. De bovenste laag werd gezaaid met 104 gelabelde hiNSC / gel in 30 pi gels, bovenop de onderste laag gepipetteerd, en volledig ingesteld bij 37 ° C. Zodra volledig gestold, werden hiNSC media toegevoegd aan putjes, en 3D constructies werden gekweekt gedurende 5 dagen in hiNSC media zonder FGF.
4.4. Neuron Migratie Assay
hDF's werden gezaaid op de bodem van celkweekplaten, vervolgens met 1 uM ivermectine of 1 uM DMSO (controle) gedurende 6 uur, en herhaaldelijk gewassen met 1 × fosfaat-gebufferde zoutoplossing (PBS) om residueel geneesmiddel te verwijderen. hiNSCs werden vooraf gedifferentieerd op gelatine in een laag-FGF media gedurende 1 week voorafgaand aan het zaaien. Gedifferentieerde neuronen gelabeld met lipofiele fluorescerende kleurstof DiD (Invitrogen) werden gezaaid op CELLstart-gecoate (Invitrogen) transwells (8 pM poriegrootte), die werden geplaatst in de putjes met hDFs. Cellen werden gekweekt in laag serum media (om potentiële celproliferatie te minimaliseren) overnacht in de aanwezigheid of afwezigheid van functionele blokkerende antilichaam geit anti-GDNF (AF-212-NA, R&D Systems, Minneapolis, MN) bij relatief lage concentratie van 10 ul/10 ml of hoge concentratie van 100 ul/10 ml, en het relatieve aantal DiD gelabelde neuronen migreren naar de bodem van de transwells werd gekwantificeerd.
4.5. Glutamaat Uptake Assay
hDF's werden behandeld met verschillende concentraties van ivermectine of DMSO 's nachts, celkweekmedia werd geoogst en gefiltreerd, vervolgens onderworpen aan een glutamaat assay (Sigma) volgens de instructies van de fabrikant.
4.6. qRT-PCR
Totaal RNA werd geïsoleerd met behulp van de RNeasy Mini kit (Qiagen), en cDNA werd gegenereerd met MLV-reverse transcriptase (Invitrogen, CA) volgens de instructies van de fabrikant. Kwantitatieve RT-PCR werd uitgevoerd met behulp van de iQ5 real-time PCR detectiesysteem (BioRad) en genormaliseerd op basis van housekeeping gen GAPDH. Alle primerreeksen zijn vermeld in Tabel S1. We voerden ook GeneQuery Human Schwann Cell Biology qPCR Array Kit (ScienCell Research Laboratories, Carlsbad, CA) uit volgens de instructies van de fabrikant.
4.7. GDNF ELISA
Een GDNF ELISA (Promega) werd uitgevoerd volgens de instructies van de fabrikant met gebruikmaking van geoogste en gefiltreerde celkweekmedia van hDF's die gedurende 4 dagen werden behandeld met verschillende concentraties ivermectine of DMSO.
4.8. Immunokleuring
Alle in vitro culturen en in vivo weefselmonsters werden gefixeerd in 4% paraformaldehyde, vervolgens gewassen met 1× fosfaat-gebufferde zoutoplossing (PBS). Drie-dimensionale collageengels en uitgesneden weefsels werden gecryosectioneerd voorafgaand aan immunokleuring. De monsters werden geïncubeerd met een blokkeerbuffer: 1× PBS met 10% geitenserum en 0,1% triton X-100. Primaire antilichamen werden toegevoegd aan de blokkerende buffer en geïncubeerd met monsters overnacht bij 4 ° C. De volgende dag werden de monsters verschillende malen gewassen met 1× PBS en vervolgens geïncubeerd met een overeenkomstig fluorescent geconjugeerd secundair antilichaam in blockingbuffer gedurende 1 uur bij kamertemperatuur (buiten het licht). Nuclei werden tegengekleurd met DAPI (Invitrogen). Alle in deze studie gebruikte antilichamen zijn vermeld in tabel S2.
4.9. Microscopie
Helderveld en fluorescerende beelden werden verkregen met behulp van een Keyence BZ-X700 microscoop en bijbehorende software. Beelden van hele mount 3D monsters werden genomen met behulp van een Olympus MVX10 macroscoop en bijbehorende software.
4.10. In vivo wondonderzoek
Dierstudies werden uitgevoerd volgens het goedgekeurde protocol #M2013-142 aan de Tufts University. Acht weken oude mannelijke BALB/c muizen (Charles River Laboratories) met een gewicht van 20-25 g werden eerst geschoren op de rug en onthaard met Nair (Carter-Wallace Inc., New York, NY). Muizen werden vervolgens verdoofd met isofluraan, en een 8 mm biopsie punch werd gebruikt om twee ronde, full-thickness excisional wonden te maken. In de rechter zijwond, 30 pi collageengels met 10 uM ivermectine of DMSO (controle) werden gepipetteerd op de wond en laat stollen. De linker zijde wonden bleven onbehandeld en diende als extra controles. Beide wonden werden afgedicht met Tegaderm, en de wond progressie werd gevolgd in de loop van 12 dagen. Per behandeling en per experiment werden drie dieren gebruikt. Aan het eind van elk onderzoek werden de dieren geëuthanaseerd en werd het weefsel van de wondplaats weggesneden voor verdere analyse.
4.11. Statistieken
Alle gegevens worden uitgedrukt als gemiddelde ± SD, met ten minste drie geanalyseerde onafhankelijke monsters per experiment. Statistisch significante verschillen werden bepaald door twee-tailed t-test of één-factor ANOVA met post-hoc Tukey test met behulp van de statistische software SYSTAT12 (Systat). Een P-waarde kleiner dan 0,05 werd als significant beschouwd.
Erkenningen
De auteurs danken Jonathan M. Grasman voor nuttige discussie.
Ga naar:
Ondersteunende informatie beschikbaar
De Ondersteunende Informatie is gratis beschikbaar op de ACS Publications website op DOI: 10.1021/acsomega.8b01451.
Karakterisering van prolifererende hiNSCs; karakterisering van voorgedifferentieerde hiNSCs; toxiciteit van ivermectine in vitro; functioneel blokkeren van ivermectine-geïnduceerde GDNF-opregulatie door hDFs voorkomt migratie van gedifferentieerde neuronen; behandeling van huidfibroblasten met ivermectine veroorzaakt een upregulatie van meerdere genen die betrokken zijn bij Schwann celdifferentiatie en -behoud, regeneratie van perifere zenuwen en synthese van de extracellulaire matrix (ECM); verschillende formuleringen van ivermectine geven vergelijkbare resultaten in hDFs in vitro; lijst van primersequenties gebruikt voor qRT-PCR-analyse; lijst van antilichamen gebruikt voor immunofluorescentieanalyse (PDF)
Ga naar:
Auteur Bijdragen
D.M.C. bedacht het idee, voerde experimenten en data-analyse uit, en schreef het artikel. J.E.G. en S.C. voerden experimenten uit en analyseerden de gegevens. D.L.K. en M.L. hielden toezicht op het project. Alle auteurs redigeerden het uiteindelijke manuscript.
Ga naar:
Opmerkingen
Dit onderzoek werd ondersteund door het Allen Discovery Center programma via The Paul G. Allen Frontiers Group (12171), alsmede de National Institutes of Health (NIH) (R01NS092847 en P41EB002520).
Ga naar:
Opmerkingen
De auteurs verklaren geen concurrerende financiële belangen te hebben.
Ga naar:
Noten
De auteurs verklaren dat de gegevens die de bevindingen van deze studie ondersteunen, beschikbaar zijn in het manuscript en de ondersteunende informatiebestanden.
Ga naar:
Aanvullend materiaal
ao8b01451_si_001.pdf(675K, pdf)
Ga naar:
Referenties