Lieve mensen,
Persbericht
Willem Engel sommeert College Beoordeling Geneesmiddelen (CBG) onmiddellijk te stoppen met “herhaalprik” Pfizer en Moderna.
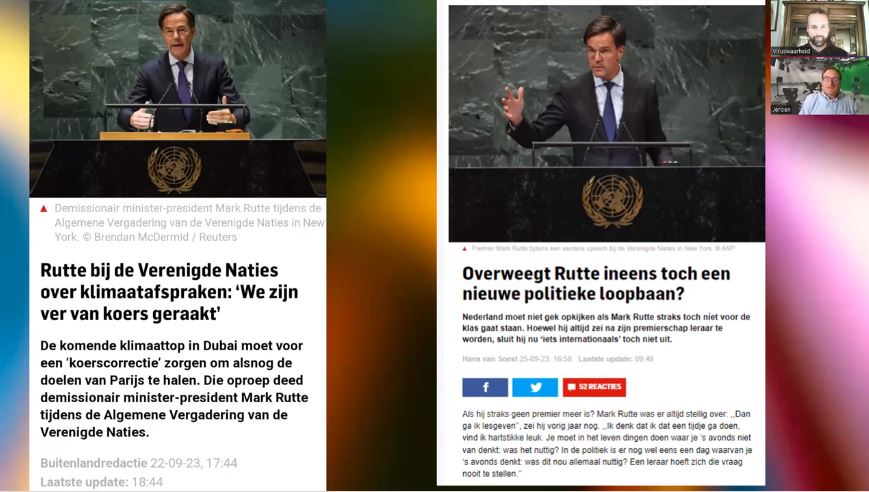
Afgelopen week verzond het RIVM 4,8 miljoen uitnodigingen voor vanaf vandaag beschikbare “herhaalprik” van Pfizer en Moderna tegen corona. Het EMA gaf een handelsvergunning af zonder de onderzoeksresultaten naar effectiviteit en veiligheid af te wachten. “Dit is een unicum, zelfs de bijsluiter met bijwerkingen ontbreekt”, aldus Willem Engel.
Het verkrijgen van een vergunning voor het op de markt brengen van een nieuw geneesmiddel is aan strenge voorwaarden onderworpen, een traject dat normaal gesproken tien tot twintig jaar duurt. Tijdens de coronacrisis kwamen na slechts negen maanden onderzoek de zogenaamde vaccins, in werkelijkheid een experimentele gentherapie, met een noodtoelatingsprocedure op de markt. Dit record is nu verbroken, veiligheids- en effectiviteitsonderzoeken voor de herhaalprik lopen pas twee maanden met als einddatum 2024, toch kregen de middelen een onvoorwaardelijke handelsvergunning. Patiënten stellen zich bloot aan grote risico’s terwijl de effectiviteit onbekend is.
Bijsluiter
De wet schrijft voor dat elk geneesmiddel voorzien moet zijn van een uitgebreide bijsluiter met mogelijke bijwerkingen en risico’s, deze ontbreekt bij de herhaalprik van Pfizer en Moderna. Volgens Engel mag een arts de middelen niet toedienen omdat hij patiënten voorafgaand niet kan informeren over gezondheidsrisico’s, een “informed consent” is daarmee onmogelijk. Dit heeft voor de toediende arts mogelijk ernstige consequenties, hij kan door de patiënt verantwoordelijk gehouden worden voor eventuele schade en bijwerkingen.
College Beoordeling Geneesmiddelen (CBG)
Het CBG is in 1963 opgericht na de zogenoemde 'Softenon affaire' waarbij aan het licht kwam, dat het gebruik van het geneesmiddel thalidomide door de moeder tijdens de zwangerschap zeer schadelijk was voor de ongeboren vrucht. Sindsdien gelden er strenge eisen wat betreft werkzaamheid, veiligheid en kwaliteit van geneesmiddelen. Het CBG heeft tot taak te waarborgen dat geen onveilige middelen op de markt komen en heeft de bevoegdheid ook in te grijpen bij door het EMA afgegeven Europese handelsvergunningen. Het CBG dient volgens de sommatie binnen 48 uur te handelen.

 videowaarheid.nl
videowaarheid.nl